ホウ素
周期表で炭素の左隣りに位置するホウ素は,三中心二電子結合という特殊な形式で互いに結合し,他の元素ではほとんど見られないユニークな構造を作る。たとえばBnHn2−の形のクラスターが数多く知られており,これらはデルタ多面体(各面が正三角形でできた多面体)の構造をとる。たとえばドデカヒドロドデカホウ酸イオンB12H122−は,正20面体の美しい骨格を持つことで知られる。
ホウ素の同素体の多くは,このB12から成る正20面体クラスターを基本としたネットワーク構造をとっている。たとえばα-菱面体ホウ素は,この正20面体クラスターが,立方最密充填に似た形で積み上がった構造だ。その他,アモルファスホウ素や,面心立方格子の金属ホウ素(高圧下でのみ存在)など,各種の構造が知られている。
ではホウ素でフラーレンのような球状ケージは構築できるのだろうか?C60と同じ形のB60は無理そうだが,六角形の面の中心にホウ素を1つずつ加えたB80なら可能性があるなどとも考えられ,理論計算も行なわれた。
しかし最近になり,B40というクラスターが発見された(Nat. Chem. 2014, 6, 727.)。ブラウン大学の王来生らが,ホウ素の単体にレーザーを照射し,ヘリウム気流で急冷することでこのクラスターの生成を確認したのだ。
ボロスフェレンと名付けられたこの分子は,ホウ素からなる三角形が48枚,6員環が2枚,7員環が4枚から成り立っている。下図のような構造で,D2d点群に属する。ちょっと想像のつかない構造で,なぜこの形が安定になるのだろうと不思議になる。今後,さらに構成原子数や構造の異なるボロスフェレン類が,新たに見つかってくる可能性もありそうだ。
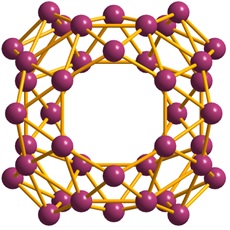
ボロスフェレン(Wikipediaより)
これと別に王らは,ホウ素がシート状に並んだ構造を考え,グラフェンとの関連から「ボロフェン」と名づけている。ホウ素から成る平面6員環を,三角形が取り囲んだような構造だ。王らは,この基本単位となるB36クラスターが生成している証拠をつかんでいる(Nat. Commun. 2013, 5, 3113.)。今後の研究次第では,ホウ素もまた炭素と同じように,「ナノボロン」の豊かな世界が拓けてゆくのかもしれない。
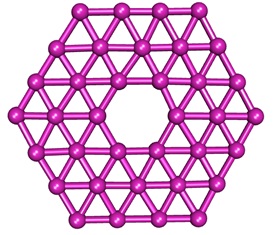
ボロフェン
ページトップへ
窒素
炭素のもう一つの隣人である,窒素ではどうだろうか。通常の気体状窒素N2以外に中性の窒素同素体は長らく知られていなかったが,2002年に四窒素(N4)の存在が確認された(Science 2002, 295, 480.)。ただし寿命は1マイクロ秒程度で,安定に単離できるようなものではない。開裂のパターンから,四窒素は直鎖状の構造を取り,2つのN2分子が弱い結合で結びついたものと見られている。
その他,ベンゼン型の構造をしたヘキサジン(N6),キュバン型の構造をしたN8,フラーレン型のN60などの存在が理論的に検討されているが,いずれも合成はなされていない。これらは分解される際に高いエネルギーを放出することが予測され,爆薬としての可能性が考えられている。
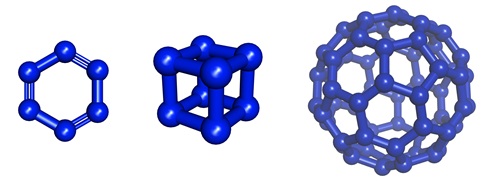
予測された窒素同素体
2004年には,ドイツのマックスプランク研究所が,「ポリ窒素」の合成を報告した(Nat. Mater. 2004, 3, 558.)。窒素を110 GPa,2000 K以上という条件で圧縮すると,窒素原子同士が単結合でネットワークを形成することがわかったのだ。
このポリ窒素,現在知られている核兵器以外の最強の爆薬に比べても,5倍以上強力な爆発力を示すと考えられている。SF作品などでこうした設定の爆弾が登場したことがあるが,それが実現したわけだ。もちろん量産も保存もできないので,兵器などとして使われる見込みは今のところない。
窒素のみから成るイオンとしては,アジ化物イオン(N3−)が古くから知られている。爆発性があるので取り扱いには注意か必要だが,防腐剤,起爆剤など用途は広い。有機合成においては,窒素導入のための試薬などとして用いられる。
ペンタゾリルアニオン(N5−)というものも存在している。これは,シクロペンタジエニルアニオンと等電子的な,窒素でできた正五角形だ。p-メトキシベンゼンジアゾニウムカチオンとアジ化物イオンの[3+2]付加環化によってペンタゾール骨格を形成し,硝酸アンモニウムセリウムで酸化的に脱保護することで得られた(Chem. Commun. 2003, 1016.)。芳香族性を持つため安定化されているが,窒素同士の反発が強いため,半減期2.2日で分解していく。
またペンタゼニウムカチオンと呼ばれる,N5+という化学種も知られている(J. Am. Chem. Soc. 2001, 123, 6308.)。アメリカ空軍による,高エネルギー物質探索プロジェクトの中で発見されたものだ。
ペンタゼニウムは,フルオロジアゾニウム(N2F+)と,アジ化物イオンの反応によって合成された。SbF6−との塩は単離ができる程度に安定で,X線結晶構造解析も行なわれている。それによるとペンタゼニウムカチオンは,5つの窒素原子が「く」の字型に折れ曲がった配列をとっているという。
理屈の上では,このペンタゼニウムカチオンと,アジ化物イオンまたはペンタゾリルアニオンとで塩を作らせれば,純粋な窒素から成る塩ができることになる。とはいっても,恐ろしく爆発力の強いイオン同士だから,こんなことを行なう者などいるまい—と思いきや,これに近い実験が行なわれており,N5+[B(N3)4]−やN5+[P(N3)6]−といった塩が実際に作られている(Angew. Chem. Int. Ed. 2004, 43, 4919.)。論文に掲載された,爆発で吹き飛んだテフロンチューブの写真や,おびただしい実験項の但し書きだけでも,その恐ろしさが伝わってくる。
ページトップへ
酸素
酸素の同素体としてよく知られているのはオゾン(O3)だろう。薄青色の有毒な気体で,フッ素に次ぐ強い酸化力を持つ。酸素への紫外線照射や無声放電によって生成し,実験室では炭素-炭素二重結合を切断する「オゾン分解」によく用いられる。最近では,水道水の消毒にオゾンを用いている地域もある。
酸素のカルテットである四酸素は,酸塩基の定義で有名なギルバート・ルイスによって,1924年に存在を予言された。しかしその確認は難航を極め,ようやく2001年になってローマ大学のグループが,質量分析によって存在を証明した。四酸素の構造は予測された4員環でもY字型でもなく,基底状態と励起状態の酸素の複合体であることが確認されている。
酸素の同素体はもう一つある。室温で酸素に高圧をかけていくと,10 GPaを超えたところで大幅に体積が減り,色が青から赤へと劇的に変化する。この「赤い酸素」の構造は長らく謎とされてきたが,2006年になって酸素4分子が集まったO8クラスター(ε酸素)構造であることが,粉末X線回折パターンから解明された(Phys. Rev. Lett. 2006, 97, 085503.)。こうした「八酸素」の構造は理論的にも全く予想されておらず,大きな驚きを与えた。
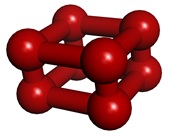
ε酸素(赤い酸素)の単位構造
というわけで,同素体の化学にはまだまだ未知の部分が眠っていそうだ。次回は,第3周期以降の元素の同素体について見ていくこととしよう。
ページトップへ




