システムメンテナンスのお知らせ 2024年12月21日(土) 午後12:30 ~ 7:00:当時間帯は当ウェブサイトがご利用いただけません。ご不便をおかけして申し訳ありませんがご理解のほどよろしくお願いいたします。
TCIメール最新号No.197 パスワード付き圧縮ファイルの利用廃止に関するお知らせ|HPMCカプセル試薬トライアルキャンペーン|キャップ天面の二次元コードで製品書類簡単取得|[TCI反応実例]ジルコノセンクロリドヒドリドを用いた… |◆TCIウェブサイトのご案内◆|※ その他のお知らせ・更新情報(2024.12.18更新)
Maximum quantity allowed is 999
注文本数を選んでください。
有用な脱離基 / Efficient Leaving Group
No.111(2001/07発行)
飽和炭素上の求核置換反応は,最も基本的で広く研究されている有機反応の一つです。この反応における脱離基としては,メシラート(Ms = CH3SO2)やトリフラート(Tf = CF3SO2)などが汎用されていますが,メシラートは反応性が弱くトリフラートは安定性が低いため,天然物合成などの際に問題になることがあります。この問題を補える脱離基として,クロロメタンスルホナート(モノクラート; Mc = ClCH2SO2)が清水,中田らにより最近見出されました。
1は,塩化メチレン溶媒中ピリジンなどの塩基存在下0℃でアルコールと反応させることにより,相当するモノクラートをほぼ定量的に与えます。多くの場合,トリフルオロメタンスルホニル化と同様に容易にクロロメタンスルホニル化は進行し,メシル化よりも早い速度で完了します。また,得られたモノクラートは精製することなく,そのまま次の反応に利用することができます。
脱離基としてモノクラートを用いることにより,第二アルコールの立体反転,炭素−炭素結合の転位,環状エーテルの環拡大などの有用な反応を行うことができます。
第二アルコールの立体反転は,アセテートを経由して行われます1)。ステロイドのモノクラート2aにベンゼン溶媒中18-クラウン-6の存在下,酢酸セシウムを作用させ加熱還流することにより,立体反転したアセテートが良好な収率で得られます。これを加水分解あるいは還元することによりほぼ定量的に相当する第二アルコールが生成します。メシラート2bを用いた場合には反応速度が非常に遅く,収率も劣っています。トリフラート2cは不安定で単離できません。
第二アルコールの立体反転は,アセテートを経由して行われます1)。ステロイドのモノクラート2aにベンゼン溶媒中18-クラウン-6の存在下,酢酸セシウムを作用させ加熱還流することにより,立体反転したアセテートが良好な収率で得られます。これを加水分解あるいは還元することによりほぼ定量的に相当する第二アルコールが生成します。メシラート2bを用いた場合には反応速度が非常に遅く,収率も劣っています。トリフラート2cは不安定で単離できません。

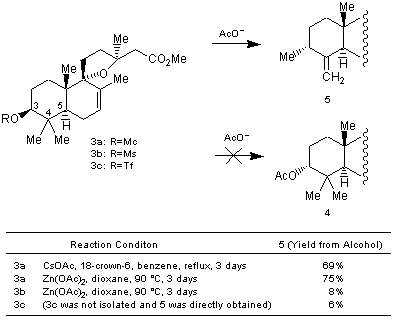
一方,C-3位の水酸基に隣接したC-4位に2つのメチル基を置換した3β-hydroxygrindelate をモノクラート3aにした後,酢酸亜鉛あるいは酢酸セシウムを作用させると炭素−炭素結合の転位反応が起こります2)。モノクラート3aに上記と同様の反応条件で酢酸セシウムを反応させると立体反転したアセテート4は得られずに,4α-メチル基が3位に転位し5が主生成物として得られます。これは,立体的に込み合っているC-3位をアセテートアニオンが攻撃できないためであると考えられています。転位生成物5は,ジオキサン中 90℃で酢酸亜鉛を反応させる条件において最も収率良く得られます。
また,モノクラートは環状エーテルの環拡大反応にも利用されます。テトラヒドロフラン化合物から誘導されたモノクラート6aを酢酸−水(1:1)混合溶媒中,酢酸亜鉛存在下50℃で加熱することにより,2,3-trans-テトラヒドロピラン7a, bが良好な収率で得られます3)。メシラート6bを用いて同様の条件下で反応を行うと未反応の6bが回収されてしまい,効率良く環拡大反応を行うには加熱還流する必要があります。また,モノクラート6aはジオキサン−水(1:1)混合溶媒を用いる中性条件下においても収率良く7aを与えるため,酸や塩基に弱い官能基を有する環状エーテルの合成に有効です。このモノクラートを利用した環拡大反応は,Hemibrevetoxin B全合成におけるCD環の合成に利用されています4)。

モノクラートを脱離基として用いる方法は,これらの他にも第二アルコールの立体反転を伴うアジドへの変換反応や第一アルコールのニトリルへの変換反応などにも利用されています2)。
文献
- 1)Efficient method for inversion of secondary alcohols
- 2)Rearrangement of the C-C bond and conversion of alcohols into azides and nitriles
- 3)Rearrangement-ring expansion of cyclic ethers
- 4)Total synthesis of hemibrevetoxine B
掲載されている情報は,ご覧の「TCIメール」発行当時のものです。ご注文の際には最新情報をご覧ください。
また,地域等によって販売製品が異なります。製品詳細ページが表示されない場合は,販売は行っておりませんのでご了承ください。
また,地域等によって販売製品が異なります。製品詳細ページが表示されない場合は,販売は行っておりませんのでご了承ください。
