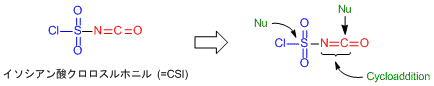【ミニコラム】 試薬の変わった使い方:
イソシアン酸クロロスルホニルの特性を生かした有機合成反応
このコーナーでは毎回,試薬の変わった使い方に焦点を当て,試薬メーカーならではの視点から使用法を紹介しています。今回はこれまでと少し趣向を変えて,反応点を多数もつ試薬を紹介しようと思います。一般に有機合成向け試薬はある特定の反応点があり,その特性を活かした使い方をされることが多いと思います。一方でジハロゲン化物やハロヒドリンなど,複数の反応活性部位をもつ試薬もたくさん売られています。もちろんこのような試薬の取扱いは比較的容易で,それら反応性の違いを巧みに利用することで,より複雑な分子構造をもつ化合物の設計と合成に役立っています。ところが,世の中にはこんな試薬が…と思うようなものも存在し,しかもそれが試薬メーカーから普通に販売されていることもあります。そこで,入手容易で薬理活性化合物の合成にも便利に使える「イソシアン酸クロロスルホニル(通称CSI)」にスポットをあて,そのちょっと変わった反応特性を紹介しようと思います。
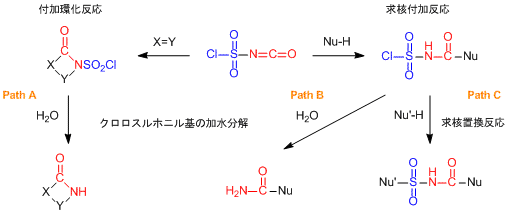
CSIは多くの研究者に使われていますが,この試薬のユニークなポイントといえば,その構造にあるのではないでしょうか。構造式を見るたびに全身反応点といっても過言ではない姿をしています。それもそのはず「Encyclopedia of Reagents for Organic Synthesis」を見てみると3つの反応点があり,イソシアネート部位と塩化スルホニル基がそれぞれ官能基特有の反応性を示すと記されています1)。すなわちイソシアネート部位ではC=N二重結合に対する付加環化反応が起こり,それに加えてC=O二重結合への求核付加反応も起こるのです。さらにもう片方の塩化スルホニル基に対しても求核置換反応が進行するというのです1,2)。こうなると逆に反応性の制御は可能なの?と勘繰りたくなりますが,これが意外と3つの反応性をそれぞれ制御することが出来てしまうから驚きです。
さて,有機合成の経験を積んでいく過程でイソシアネート部位の反応性の高さ,そしてクロロスルホニル基の安定性を体験的に理解することができると思います。そして,実際にCSIを用いた反応ではイソシアネート基が優先的に反応するので,3つの反応点をもつにも関わらず反応性を制御することができるのです。特にC=N二重結合に対する付加環化反応で生成するβ-ラクタム環は,β-ラクタム系薬理活性化合物の合成には欠かせないものです(Path A)。そうなると塩化スルホニル基をどう反応に生かそう?と思いますが,これにもいつくか使い方があります。Path Cのようにイソシアネート部位を反応させた後,残ったクロロスルホニル基に求核剤を作用させる方法は,最も簡単なアプローチといえます。身近な例ではアルコール類をアミン類やオレフィンに変換するBurgess試薬の合成に,この方法が活用されており,Organic Syntheses 誌にその具体的な内容が掲載されています3)。そして別のアプローチから塩化スルホニル基を活用する使い方,それが水による加水分解です1,2)。
Path AやPath Bの反応で示したようにCSIの反応中間体を水で処理すると,塩化スルホニル基は加水分解を受けてアミン類に変換されます。この反応の結果をよく見ると,イソシアン酸を出発原料として反応を行った場合と同じ化合物が得られているのが判ります。すなわちCSIはイソシアン酸等価体として使うこともできるのです。イソシアン酸は毒性が強く低沸点なため,できれば使用を避けたい化合物です。そのためCSIを代替試薬として使う方法は実用性の高い手法といえます。
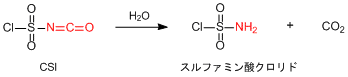
ここまでCSIの反応性について話してきましたが,反応性が良いと逆に安定性や毒性はどうなんだろう?と気になるものです。CSIはイソシアネート誘導体のひとつなので毒性を有しています。また吸湿分解のし易さも例外ではなく,水とは非常に激しく反応しますので吸湿は極力避ける必要があります。となると保管はなかなか難しそう。そう感じられるかもしれません。では,実際に吸湿分解してしまったら試薬としてもう使えないのでしょうか…CSIの場合は少し事情が異なります。CSIが水と反応すると下図に示した反応が起こります。
イソシアネート部位が加水分解を受けて結晶性のスルファミン酸クロリドが生成します。実験でCSIを何度か使用していると蓋の周りやビンの中に固形物が生じてきますが,これは吸湿分解によりスルファミン酸クロリドが析出したことが原因だったのです。スルファミン酸クロリドは固体であるのに対し,CSIは液体です。したがって,上澄み液の部分には純度の高いCSIがまだ残っていて,試薬としてまだ使えることもあります。
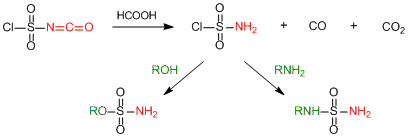
ところでスルファミン酸クロリドといえば,スルホンアミド結合の形成に使える試薬です。ということはCSIを別の視点から捉えると,スルファミン酸クロリド前駆体としての用途が見えてきます。実際には水で加水分解して発生させるのは危険を伴うので,CSIに等量のぎ酸を作用させて発生させる方法が広く使われています4)。
スルファミン酸クロリドの調製と有機合成反応への利用
このやり方で調製を行うと,液体のCSIが分解して結晶性のスルファミン酸クロリドが析出してくる様子がよくわかります。反応性も良好で,アルコール,アミンなどと反応して相当するスルホンアミド誘導体を与えます。この反応は特にアミノ基フリーな末端スルホンアミド誘導体の合成には欠かせない手法となっています。
CSIは特徴ある2つの官能基に起因する多彩な反応性が最大の持ち味ですが,イソシアン酸等価体としての使い方や,スルファミン酸クロリドのin situ調製試薬といった,まったく別の顔もあわせ持つユニークな試薬です。特に薬理活性化合物に多く見られるスルホンアミド骨格の導入に対してCSIは,強力なツールとなるでしょう。薬理活性化合物の合成戦略のひとつの手法として,ぜひイソシアン酸クロロスルホニルを取り入れてみてください。
文献
- 1)M. J. Miller, M. Ghosh, P. R. Guzzo, P. F. Vogt, J. Hu, in Encyclopedia of Reagents for Organic Synthesis, ‘Acetone Cyanohydrin’, John Wiley & Sons, 1995, 1213.
- 2)D. N. Dhar, K. S. K. Murthy, Synthesis 1986, 437.

- 3)E. M. Burgess, H. R. Penton, Jr., E. A. Taylor, W. M. Williams, Org. Synth. 1977, 56, 40.
- 4)R. Appel, G. Berger, Chem. Ber. 1958, 91, 1339.

掲載されている情報は,ご覧の「TCIメール」発行当時のものです。ご注文の際には最新情報をご覧ください。
また,地域等によって販売製品が異なります。製品詳細ページが表示されない場合は,販売は行っておりませんのでご了承ください。